
圖:工作人員在國(guó)藥集團(tuán)中國(guó)生物新冠疫苗生產(chǎn)基地尚未投產(chǎn)的新型冠狀病毒滅活疫苗生產(chǎn)車間內(nèi)調(diào)試設(shè)備\新華社
日前�����,中國(guó)首個(gè)新冠病毒滅活疫苗臨床試驗(yàn)在全球率先獲批啟動(dòng)��,以往創(chuàng)新性疫苗研發(fā)大概需要10年左右�����,這次從毒株獲得到疫苗研發(fā)�����,只用了98天就獲得臨床批件����,這被外媒解讀為“中國(guó)超速全球”。這次疫苗研發(fā)同時(shí)在多種試驗(yàn)動(dòng)物身上開展研究�,研發(fā)和申報(bào)材料提交同步進(jìn)行。此外,國(guó)家啟動(dòng)特殊審批機(jī)制�����,加速推進(jìn)疫苗的審評(píng)審批��。疫苗研制單位相關(guān)負(fù)責(zé)人透露��,根據(jù)疫情防控需要��,可按照相關(guān)規(guī)定進(jìn)行疫苗應(yīng)急使用�。\大公報(bào)記者 周琳、凱雷
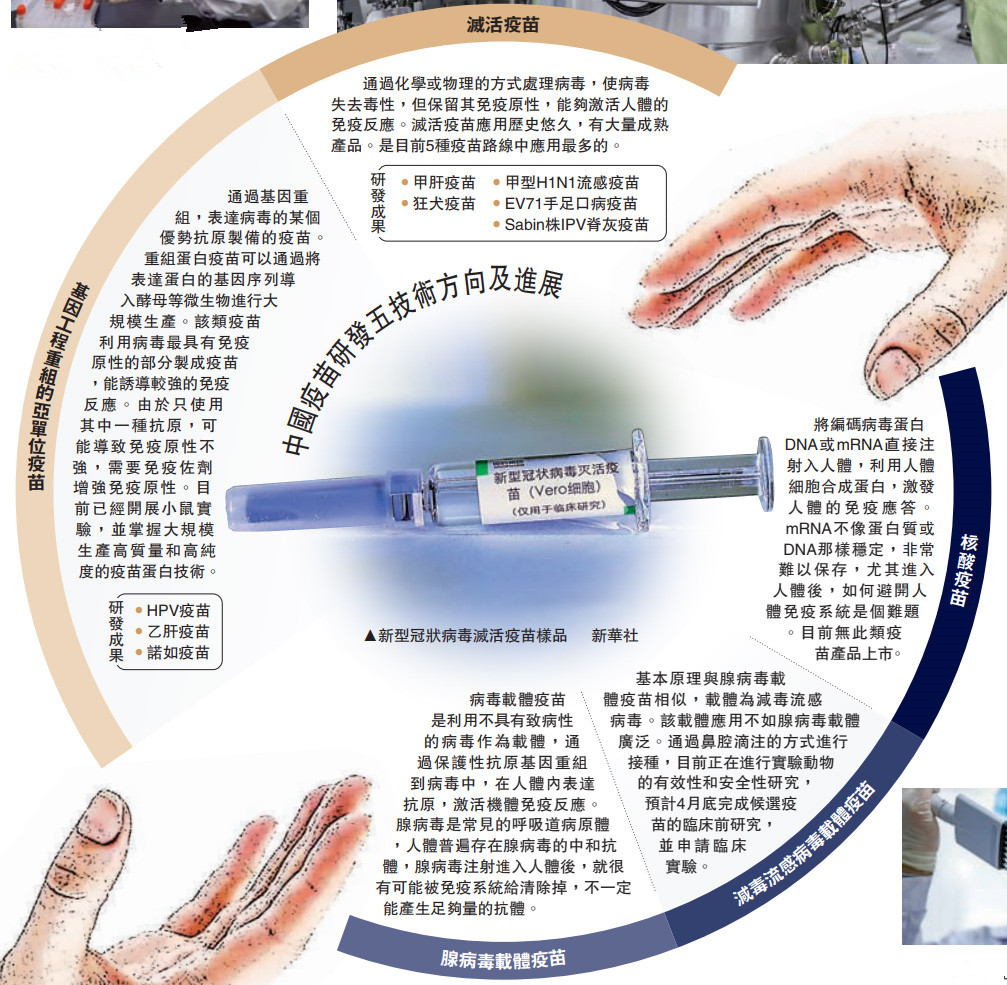
當(dāng)前�����,中國(guó)疫苗應(yīng)急攻關(guān)正按照滅活疫苗��、重組蛋白疫苗�、腺病毒載體疫苗、減毒流感病毒載體活疫苗����、核酸疫苗5條技術(shù)路線推進(jìn)。繼軍事科學(xué)院陳薇團(tuán)隊(duì)牽頭研發(fā)的腺病毒載體疫苗進(jìn)入II期臨床之后����,國(guó)藥集團(tuán)中國(guó)生物武漢生物制品研究所及北京科興中維生物技術(shù)有限公司研制的滅活疫苗日前再獲得國(guó)家藥品監(jiān)督管理局I�、II期合并的臨床試驗(yàn)許可���。全球五款新冠疫苗進(jìn)入臨床試驗(yàn)��,中國(guó)獨(dú)占其三。
“作戰(zhàn)狀態(tài)” 日做16小時(shí)
“在4月12日拿到疫苗臨床試驗(yàn)批件之前����,我們進(jìn)行了98天的晝夜奮戰(zhàn)。”回憶這段時(shí)間�����,國(guó)藥集團(tuán)中國(guó)生物技術(shù)股份有限公司副總裁張?jiān)茲龑⑵浞Q為“作戰(zhàn)狀態(tài)”�。一個(gè)創(chuàng)新性疫苗的研發(fā),大概需要10年左右���,這次的疫苗為何能如此快速�?
“以前的工作是做完A做B依次進(jìn)行���,現(xiàn)在是ABCD同步進(jìn)行��。”張?jiān)茲榻B��,比如在疫苗的有效性評(píng)價(jià)環(huán)節(jié)���,以往的方式是對(duì)不同種類的動(dòng)物逐一進(jìn)行有效性試驗(yàn)���,采用并聯(lián)的方式后,則是同時(shí)在大鼠��、小鼠��、豚鼠及恒河猴等多種試驗(yàn)動(dòng)物身上開展免疫原性研究�。另一方面監(jiān)管審批也啟動(dòng)了特殊審批機(jī)制,在標(biāo)準(zhǔn)不降低�����、流程不減少的情況下���,加速推進(jìn)疫苗的審評(píng)審批����。
“我們每天工作都在16個(gè)小時(shí)以上���,相當(dāng)于把一天當(dāng)成2天����、3天來用。”武漢生物制品研究所有限責(zé)任公司病毒性疫苗研究一室主任王澤鋆說����。
在研發(fā)加速的同時(shí),國(guó)家藥監(jiān)局也開通了綠色通道����,以往需要將申報(bào)材料一次性提交�,現(xiàn)在研發(fā)機(jī)構(gòu)可以滾動(dòng)式提交,國(guó)家藥監(jiān)局則同步進(jìn)行審核��,以提高審批速度���。

臨床后上市至少需一年
張?jiān)茲榻B����,目前疫苗的臨床試驗(yàn)共分為三期�����。Ⅰ/Ⅱ期臨床計(jì)劃采用序貫入組的方式開展,大約需要4-5個(gè)月���,觀察安全性和初步的免疫原性�����,并確定Ⅲ期臨床所使用的劑量�����。對(duì)于一個(gè)新發(fā)傳染病��,Ⅲ期臨床需要進(jìn)行保護(hù)性評(píng)價(jià)��,根據(jù)新冠病毒的流行狀況���,至少需要半年時(shí)間。因此進(jìn)入臨床后至上市�,至少1年到1年半的時(shí)間。
張?jiān)茲赋?�,Ⅲ期臨床考慮開展國(guó)際多中心研究或在國(guó)外獨(dú)立啟動(dòng)臨床兩種方式開展�����,待獲得全部臨床數(shù)據(jù)后由藥監(jiān)局審批上市。
及時(shí)調(diào)整策略 應(yīng)對(duì)變異可能

圖:工作人員在尚未投產(chǎn)的新型冠狀病毒滅活疫苗生產(chǎn)車間的病毒培養(yǎng)/滅活區(qū)入口旁交流\新華社
值得關(guān)注的是����,印度科研團(tuán)隊(duì)日前分離出的一株新冠病毒產(chǎn)生了基因突變。國(guó)藥集團(tuán)中國(guó)生物技術(shù)股份有限公司副總裁張?jiān)茲龑?duì)大公報(bào)指出����,從目前數(shù)據(jù)來看,病毒發(fā)生蛋白質(zhì)水平上大的變異的可能性極低�。團(tuán)隊(duì)將在疫苗研發(fā)過程中進(jìn)行不同毒株的交叉保護(hù)實(shí)驗(yàn),根據(jù)研究進(jìn)展和現(xiàn)實(shí)需要�����,及時(shí)調(diào)整研發(fā)策略���。
他介紹,RNA病毒在傳播的過程中出現(xiàn)基因組部分位點(diǎn)的變異是一種常見現(xiàn)象�����,病毒只有在蛋白質(zhì)水平發(fā)生非常大的變異時(shí)���,相互作用的受體和靶點(diǎn)才可能改變��。
國(guó)家儲(chǔ)備疫苗 應(yīng)急備用
“從目前數(shù)據(jù)來看���,病毒發(fā)生蛋白質(zhì)水平上大的變異的可能性極低�����。”張?jiān)茲硎?�,團(tuán)隊(duì)將在疫苗研發(fā)過程中進(jìn)行不同毒株的交叉保護(hù)實(shí)驗(yàn)�����,如果都能夠中和���,那么對(duì)疫苗的研發(fā)就沒有影響。他強(qiáng)調(diào)����,對(duì)于新冠病毒,還要重點(diǎn)關(guān)注疫苗可能產(chǎn)生抗體依賴的疾病增強(qiáng)現(xiàn)象(ADE現(xiàn)象)����,需要對(duì)免疫后的動(dòng)物進(jìn)行病理學(xué)分析。
沙士時(shí)期,眾多國(guó)內(nèi)外企業(yè)參與了研發(fā)疫苗��,但到可大規(guī)模實(shí)驗(yàn)時(shí)����,疫情卻至尾聲,最終導(dǎo)致彼時(shí)疫苗研發(fā)的擱置�����。張?jiān)茲硎?��,臨床試驗(yàn)分三期���,目前,海外疫情正持續(xù)暴發(fā)��,開展臨床研究還有一定機(jī)會(huì)����,如果國(guó)內(nèi)外疫情都降下來���,人群發(fā)病很少的情況下�����,新冠肺炎疫苗有可能在完成Ⅱ期臨床研究以后���,作為國(guó)家的儲(chǔ)備疫苗儲(chǔ)備下來���,將來在應(yīng)急狀況下使用。
免疫保護(hù) 受試者無(wú)需隔離

圖:工作人員在滅活疫苗生產(chǎn)車間內(nèi)的隔離器旁調(diào)試設(shè)備\新華社
作為全球首個(gè)新冠病毒滅活疫苗����,國(guó)藥集團(tuán)中國(guó)生物在河南省焦作市武陟縣開展的臨床試驗(yàn)備受關(guān)注。國(guó)藥集團(tuán)中國(guó)生物技術(shù)股份有限公司副總裁張?jiān)茲榻B���,Ⅰ期臨床試驗(yàn)受試者最多打三針��。因?yàn)橐^察的是安全性���,所以要覆蓋未來可能給藥的最多針次。
大公報(bào)記者在中國(guó)臨床注冊(cè)中心查詢到�����,該疫苗試驗(yàn)I期/II期合并注冊(cè)�,通過隨機(jī)、雙盲、安慰劑平行對(duì)照的方式展開��,試驗(yàn)對(duì)象要求為6歲及以上的健康人群����,要求受試者從2019年12月至今未去過湖北、境外及出現(xiàn)過疫情的村/社區(qū)����,未接觸新型冠狀病毒感染者或疑似病例,處于非隔離期內(nèi)的人員���,且同村/社區(qū)內(nèi)未出現(xiàn)新型冠狀病毒感染者或疑似病例��。試驗(yàn)的注冊(cè)日期是從2020年4月11日到2021年11月10日��。

試驗(yàn)測(cè)量不良反應(yīng)率
受試者將分為Ⅰ�、Ⅱ期�����,各期再分為低劑量組��、中劑量組和高劑量組���,各組均設(shè)置安慰劑對(duì)照組�����。Ⅰ期試驗(yàn)組每組24人����,對(duì)照組8人��;Ⅱ期試驗(yàn)組每組60人�����,對(duì)照組20人�����。試驗(yàn)的主要測(cè)量指標(biāo)是每劑接種后的不良反應(yīng)的發(fā)生率����,次要指標(biāo)包括抗新型冠狀病毒血清抗體4倍增長(zhǎng)率和抗體水平以及細(xì)胞免疫。
由于新冠肺炎是一個(gè)覆蓋全年齡段的疾病�����。因此覆蓋6歲到60歲以上全年齡段的觀察。張?jiān)茲硎?��,疫苗在臨床前已做了7種動(dòng)物的免疫保護(hù)研究和安全性觀察���,因此受試者不需隔離,可以居家觀察��,每天主動(dòng)加強(qiáng)隨訪���。













